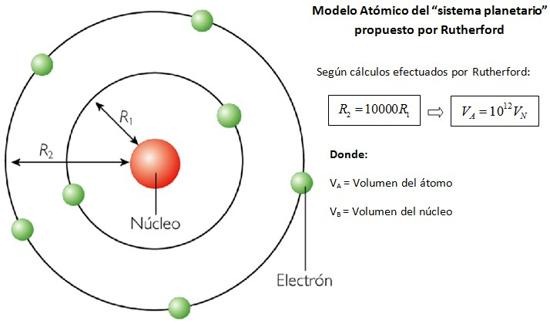
Según Rutherford, el atomo es un sistema dinámico, con un núcleo de carga positiva y los electrones girando alrededor siguiendo trayectorias circulares y concéntricas a una gran velocidad, de tal modo que se neutralice la fuerza de atracción eléctrica que ejerce el núcleo; por lo tanto los electrones estarían girando alrededor en estado de equilibrio.
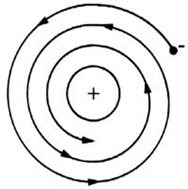
Error en el Modelo de Rutherford: Según la física clásica (electrodinámica clásica), una partícula electrizada o cargada eléctricamente que se mueve con velocidad variable (con aceleración) emite o pierde energía constantemente en forma de ondas electromagnéticas). Por lo tanto el electrón que es una partícula con carga negativa y viaja con aceleración angular debido a que describe trayectoria circular, debe constantemente perder energía y acercarse poco a poco al núcleo siguiendo una trayectoria en espiral y finalmente caer al núcleo, o sea hasta la autodestrucción o colapsamiento del atomo, lo cual nunca ocurre.
Por lo tanto la física clásica no servía para explicar fenómenos atómicos y era necesario una nueva física en base a nuevos principios y leyes para las partículas su microscópicas como átomos, moléculas y partículas subatómicas, que hoy en día se llama mecánica cuántica (relativística y no relativística)
http://www.fullquimica.com/2011/03/modelo-atomico-de-rutherford-1911.html

No hay comentarios:
Publicar un comentario